О компетентности персонала и систематических ошибках, допускаемых сотрудниками испытательных лабораторий предприятий масложировой отрасли
УДК 665.0
Волкотруб С.Л., Григорова Л.И., Свирская Т.А., Петик П.Ф., Украинский НИИ масел и жиров НААН
Контроль технологических процессов и качества масложировой продукции всегда будет относиться к главнейшим задачам производства.
Комплексный подход к проблеме контроля подразумевает использование методов и средств измерения, позволяющих достоверно установить значение определяемого показателя, и обеспечение выполнения исследований компетентным персоналом испытательных лабораторий (ИЛ).
В ДСТУ ISO 17025-2006 «Общие требования к компетентности испытательных и калибровочных лабораторий» особое внимание уделяется качеству работы испытательной лаборатории и требованиям к ее персоналу. Отмечено, что в лаборатории необходимо осуществлять соответствующий контроль сотрудников и стажеров, выполняющих испытания, с оценкой выдаваемых ими результатов (п.4.1.4). А также необходимо осуществлять внутренний контроль деятельности (п.4.13.1), обеспечивать компетентность персонала, включая его образование, повышение квалификации, опыт работы, обеспечивать знание методов и качество результатов испытаний.
Специалистами Украинского научно-исследовательского института масел и жиров Национальной академии аграрных наук Украины систематически проводится обучение сотрудников лабораторий масложировой отрасли с проведением семинаров как в лаборатории института, так и в заводских лабораториях. С этой целью была создана программа обучения, которая включает теоретические основы методов исследования и практическую подготовку сотрудников заводских лабораторий. Особо хотелось бы отметить важность практических занятий, где каждый обучающийся имеет возможность самостоятельно выполнять исследования и приобретать навыки практической работы. В программе обучения в первую очередь уделено внимание физико-химическим методам анализа сырья и готовой продукции (масличные семена, жмыхи, шроты, фосфатидный концентрат и масла), так как аппаратные методы, применяемые в заводских лабораториях, базируются на классических физико-химических методах.
Требования к сотрудникам лабораторий, выполняющим испытания продукции:
- сотрудник производственной лаборатории должен быть компетентным в теоретических основах методов исследования;
- уметь работать с нормативной документацией, а именно ДСТУ, ГОСТ, СОУ, МВИ и т.д.;
обязан быстро ориентироваться в конкретной производственной ситуации, на высоком профессиональном уровне решать различные производственные задачи, какой бы узкой ни была его специализация.
Сотрудник производственной лаборатории, получив результат исследований, должен:
- дать оценку правильности проведенных испытаний;
- сопоставить полученные результаты с ДСТУ на технические условия данного вида продукции и нормами, заложенными в нормативном документе;
- сделать вывод о качестве конкретного вида продукции.
На большинстве промышленных предприятий масложировой отрасли в испытательных лабораториях работают выпускники факультетов учебных заведений, не обеспечивающих необходимый практический уровень знаний в области аналитической химии, методологии химического анализа и метрологии, поэтому необходимо проводить дополнительное обучение работников заводских лабораторий.
По-видимому, это всегда будет одной из причин большого числа «тревожных» и неточных результатов испытаний. Для повышения конкурентоспособности продукции предприятий пищевой и перерабатывающих отраслей представляется очевидной актуальность работы в следующих направлениях:
- организация внутрилабораторного контроля;
- более активное привлечение персонала к участию в раундах профессионального тестирования;
- межлабораторным сличительным испытаниям (МСИ).
В мировой практике МСИ служит основным средством оценки компетентности лабораторий создание региональных центров подготовки, переподготовки и повышения квалификации.
Правильное проведение любого испытания в лабораторной работе невозможно, если исполнитель не понимает их смысла и тех теоретических предпосылок, которые лежат в основе проведения испытания.
В процессе обучения были определены наиболее часто встречаемые систематические ошибки в проведении испытаний.
У сотрудников лабораторий наибольшие затруднения вызывают титриметрические методы анализа.
Титриметрия – это метод количественного анализа, основанный на точном измерении объема раствора реактива известной концентрации, израсходованного на химическую реакцию с определяемым веществом. Основным достоинством метода является точность, быстрота исполнения и возможность определения самых разнообразных веществ.
Например, в ДСТУ на титриметрические методы определения (например кислотного числа, перекисного числа, йодного числа и т.д) в главе «Обработка результатов» в формулах используют обозначение «С» – действующая концентрация раствора. У многих лаборантов эта формулировка вызывала затруднение в понимании, несмотря на ссылку в вышеназванных методах на ГОСТ 25794.1. Этот стандарт распространяется на реактивы и устанавливает методы приготовления титрованных растворов и проверку их молярных концентраций. Необходимо отметить, что вышеуказанный стандарт ГОСТ 25794.1 отменен, и с марта 2013 года действуют новые стандарты на методы приготовления титрованных растворов: ДСТУ 7258:2012 «Химические реактивы. Методы приготовления растворов для кислотно-щелочного титрования и определение их молярной концентрации»; ДСТУ 7259:2012 «Химические реактивы. Методы приготовления растворов для окислительно-восстановительного титрования и определение их молярной концентрации»; ДСТУ 7260:2012 «Химические реактивы. Методы приготовления растворов для титрования осаждением и неводного титрования и определения их молярной концентрации».
Точность приготовления химических растворов – непременное условие правильности выполнения измерений. Приготовление растворов точно известной концентрации требует соблюдения особых правил и приемов исключительной точности и аккуратности в работе.
Точные объемы растворов в титриметрическом анализе отмеряют с помощью мерной посуды – мерных колб, пипеток, бюреток. Средства измерения должны быть откалиброванными согласно ДСТУ 7259:2012 (приложение А: «Градуирование мерной посуды») один раз в год.
Готовят титрованные растворы и определяют их молярную концентрацию при таких условиях:
- температура окружающей среды от 15ºC до 25ºС;
- относительная влажность воздуха до 80%;
- атмосферное давление от 84 кПа до 106 кПа.
Температура, при которой определяют молярную концентрацию титрованного раствора, должна быть зафиксирована. Если этот раствор используют при температуре иной, чем температура, при которой определяли его молярную концентрацию, значение этой молярной концентрации корректируют согласно поправкам, приведенным в ДСТУ 7259:2012 (приложение В: «Расчеты температурных поправок к значениям молярной концентрации компонентов титрованных растворов»).
Исправленные молярные концентрации компонентов титрованных растворов вычисляют по формуле:
Сt2 = Сt1 + (t1 – t2)•F , (1)
где:
Сt2 ― молярная концентрация компонента титрованного раствора при температуре его использования, моль/дм3;
Сt1 ― молярная концентрация компонента титрованного раствора при температуре ее определения, моль/дм3;
t1 ― температура, при которой определяли молярную концентрацию компонента титрованного раствора, ºС;
t2 ― температура, при которой используют титрованный раствор, ºС;
F ― поправочный коэффициент, который учитывает термическое расширение раствора, моль/дм3 ºС.
Приготовив раствор, нужно обязательно проверить его концентрацию с помощью титрования соответствующим раствором другого вещества с известной концентрацией. Приготовленный раствор может не отвечать точно той концентрации, которая задана. В таких случаях вводят поправку.
Ниже приведены формулы определения молярных концентраций.
1. Точную молярную концентрацию (C, моль/дм3) с коэффициентом поправки вычисляют по формуле:
С = С1 • К, (2)
где: С1 – заданная молярная концентрация вещества в растворе, моль/дм3;
К – коэффициент поправки.
Для определения коэффициента поправки титрованного раствора применяют стандартные вещества (установочные вещества) или стандартные растворы.
Установочным веществом называют химически чистое соединение (класс чистоты х.ч.), устойчивое при хранении, сравнительно хорошо растворимое, и его состав строго соответствует определенной формуле. На основании данных титрования установочного вещества вычисляют точную концентрацию приготовленного раствора.
2. Точную молярную концентрацию (C, моль/дм3) без коэффициента поправки вычисляют по формуле:
С = (m1*1000)/(M1*V), (3)
где: m1 – масса навески установочного вещества, г;
М1 – молярная масса эквивалента установочного вещества, г/моль;
V – объем анализируемого раствора, израсходованный на титрование, см3.
Вызывает затруднение сотрудников лабораторий определение коэффициента поправки.
3. Определение коэффициента поправки следующее:
3.1. При применении установочного вещества коэффициент поправки вычисляют по формуле:
К = (m1*1000)/(M1* c1*V), (4)
где: m1 — масса навески установочного вещества, г;
М1 — молярная масса эквивалента установочного вещества, г/моль;
с1 — заданная молярная концентрация вещества в растворе, моль/дм3;
V — объем анализируемого раствора, израсходованный на титрование, см3.
3.2. При применении раствора установочного вещества (заданная молярная концентрация растворов одинаковая) коэффициент поправки вычисляют по формуле:
К1 =(V*K)/V1, (5)
где: V — объем раствора установочного вещества, взятый или израсходованный на титрование, см3;
К — коэффициент поправки раствора установочного вещества;
V1 — объем анализируемого раствора, взятый или израсходованный на титрование, см3.
Необходимо отметить, что для установления коэффициента поправки используют не менее трех навесок установочного вещества. Из вычисленных значений коэффициентов берут среднее арифметическое. Это значение коэффициента поправки должно быть равным 1,00 ± 0,03. Если коэффициент поправки выходит за указанные пределы, то раствор соответственно концентрируют или разбавляют. Согласно ДСТУ 7258:2013, ДСТУ 7259:2013, ДСТУ 7260:2013, вычисляют не коэффициент поправки, а «С» – действующая концентрация раствора, которая рассчитывается по формуле 3.
На практических занятиях сотрудники лабораторий определяли коэффициенты поправок и концентрацию титрованных растворов для определения кислотного числа, перекисного числа с учетом температурных поправок, что зачастую ими не учитывалось. Кислотное и перекисное число определяют не только в маслах, но и в жмыхах и шротах, фосфатидных концентратах.
В титриметрии приходится проводить различные расчеты при приготовлении или разбавлении растворов, переходе от одних способов выражения концентраций к другим и т.п.
Единицей измерения количества вещества является моль, одна из семи основных единиц Международной системы единиц физических величин (СИ).
Моль – это количество вещества, которое содержит столько определенных условных частиц (УЧ), сколько атомов содержится в 0,012 кг углерода- (12С), т.е. 6,0221367• 1023 частиц (число Авогадро).
УЧ — это любой вид реальных частиц (атомы, молекулы, ионы, электроны, радикалы и т.п.) или условно существующих частиц реальных частичек (например, 1/2 Ва2+, 1/5 КMnО4 и т.п.).
Итак, главная единица измерения количества вещества моль относится к любым видам частиц или определенных групп частиц. Вот почему при использовании термина «моль» эти частицы необходимо обязательно указывать.
Международный союз теоретической и прикладной химии (ИЮПАК) (IUPAC) рекомендовал для использования номенклатуру, получившую название номенклатура ИЮПАК.
В правилах ИЮПАК отмечается, что понятие эквивалентности веществ, которые реагируют в химических реакциях, было и остается одним из главных понятий в химии, и даются рекомендации относительно использования терминов «эквивалент» и «нормальный» в реакциях кислотно-основного взаимодействия, окислительно-восстановительных и комплексообразования.
В настоящее время термин «нормальная концентрация» не применяется, вместо нее используют термин «молярная концентрация эквивалента».
Эквивалент вещества – это реальная или условная частица этого вещества, которое в кислотно-основной реакции освобождает один гидроген (1+)- ион или соединяется с ним, а в окислительно-восстановительной реакции присоединяет или освобождает один электрон.
Эквивалент вещества разный и зависит от реакции, в которой это вещество принимает участие.
Число, которое показывает, какая доля частиц вещества Х эквивалентна одному гидроген (1+)- иону в данной кислотно-основной реакции, называется фактором эквивалентности вещества X. Фактор эквивалентности – это величина безразмерная.
В общем виде фактор эквивалентности вещества X обозначается символом fэкв (Х).
Величина fэкв (Х)Х называется эквивалентом вещества Х, или эквивалентной формой вещества X и является общей формой обозначения всех частичек, которые реагируют в кислотно-основных или окислительно-восстановительных реакциях.
Фактор эквивалентности – величина непостоянная (как правило), поскольку один и тот же элемент может проявлять разные валентности, одно и то же вещество может вступать в разные реакции.
Молярная масса эквивалента определяется как молярная масса вещества, умноженная на фактор эквивалентности:
M(fX) = M(X)•f (6)
Итак, фактор эквивалентности вещества X рассчитывают на основе стехиометрических коэффициентов реакции. Вот почему при определении фактора эквивалентности вещества X обязательно указывать уравнение реакции при участии этого вещества.
По всей видимости, фактор эквивалентности вещества в реакциях может быть равен или меньше единицы. Если фактор эквивалентности равен 1, то эквивалент идентичен самой реагирующей частице.
Величину фактора эквивалентности кислот, основ, солей в обменных реакциях в общем виде можно рассчитать по формуле:
fэкв (X) = 1/z , (7)
где:
- для кислот z – число атомов водорода, которые могут быть замещены в молекуле кислоты атомами металла;
- для оснований z – это число гидроксильных групп, которые могут быть замещены кислотным остатком;
- для солей z равняется q•n, де q– заряд катиона металла, n – число катионов в формуле соли.
Для определения факторов эквивалентности окислителей и восстановителей в окислительно-восстановительных реакциях обязательно нужно использовать схему электронного баланса. Число z для вещества в этом случае равно числу принятых или отданных электронов молекулой вещества.
Концентрация – это важнейшая характеристика любого раствора. Она определяет содержимое вещества в единице массы или объема раствора (иногда растворителя).
ИЮПАК рекомендует использовать несколько способов выражения количественного состава растворов, которые основываются на постоянстве массы раствора, растворенного вещества, растворителя или объема раствора.
1. Массовая доля вещества в растворе – W(X) – отношение массы растворенного вещества m(Х), содержащегося в растворе, к общей массе этого раствора mр
Форма записи: или
или  , (8)
, (8)
где:
Х – растворенное вещество;
m(X) – масса вещества, г;
mp – масса раствора, г.
Единицы измерения: разрешается выражать массовую долю вещества в долях единицы или в процентах. W(X) в % называется также процентной концентрацией и равна массе вещества в 100 г раствора.
2. Молярная концентрация вещества X в растворе — это отношение количества вещества n(X), содержащегося в растворе, к объему (Vр) этого раствора.
В СИ основной единицей молярной концентрации является моль/м3, а для практического использования — моль/дм3.
Форма записи: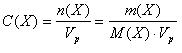 , (9)
, (9)
где :
m(X) – масса вещества, г;
Vр – объем раствора, см3;
n(Х) – количество вещества, моль;
М(X) – молярная масса вещества, г/моль.
Не допускается сокращение М для обозначения единиц измерения молярной концентрации. Не следует писать С(HCl)=0,1 М, а необходимо писать моль/дм3.
3. Молярная концентрация эквивалента в растворе (устаревшее название нормальная концентрация) — это отношение числа моль эквивалентов (n(fэкв(Х)Х)) в растворе к объему этого раствора вещества (Vр).
Форма записи: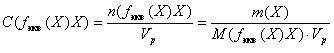 (10)
(10)
где:
m(X) – масса вещества, г;
Vр – объем раствора, см3;
fэкв (X) – фактор эквивалентности вещества;
n(fэкв (X)X) – количество вещества эквивалента, моль;
M(fэкв (Х)Х) – молярная масса эквивалента вещества, г/моль.
Единицей измерения молярной концентрации эквивалента является моль/дм3.
Не допускается сокращение «н.» для обозначения единиц измерения молярной концентрации эквивалента. Не следует писать
с(1/2 H2SO4) = 0.1 н. Использование терминов «грамм-эквивалент» и «грамм-эквивалент/литр» также не допускается!
Между молярной концентрацией вещества X в растворе и молярной концентрацией эквивалента вещества X в растворе есть связь: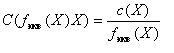 (11)
(11)
Титр раствора – это масса вещества Х, которая содержится в 1 см3 раствора. Форма записи: (12)
(12)
Единицы измерения: кг/см3, для практического пользования – г/см3, г/мл (последняя – не системная).
В 2013 году введены впервые новые нормативные документы на методы приготовления титрованных растворов, а именно ДСТУ 7258:2012 «Химические реактивы. Методы приготовления растворов для кислотно-щелочного титрования и определение их молярной концентрации» (с отменой в Украине ГОСТ 25794.1-83); ДСТУ 7259:2012 «Химические реактивы. Методы приготовления растворов для окислительно-восстановительного титрования и определение их молярной концентрации» (с отменой в Украине ГОСТ 25794.2-83); ДСТУ 7260:2012 «Химические реактивы. Методы приготовления растворов для титрования осаждением и неводного титрования и определение их молярной концентрации» (с отменой в Украине ГОСТ 25794.3-83).
Проанализируем расхождения в методах определения действительной концентрации титрованных растворов согласно новым вышеупомянутым стандартам и прежде действующим ГОСТ 25794.1-83 – ГОСТ 25794.3-83 «Реактивы. Методы приготовления титрованных растворов»:
- Согласно ГОСТ 25794.1-83 допускалось готовить титрованные растворы с использованием стандартов-титров (фиксаналы), а согласно ДСТУ 7258:2012; ДСТУ 7259:2012 и ДСТУ 7260:2012 титрованные растворы готовят только из конкретного значения массы реактива.
- Согласно ГОСТ 25794.1-83 для определения молярных концентраций титрованного раствора допускалось использовать несколько видов реактива установочного вещества. Например:
― определение коэффициента поправки титрованного раствора с(NaOH) = 1 моль/дм3, с(NaOH) = 0,5 моль/дм3, с(NaOH) = 0,1 моль/дм3 осуществлялось с использованием реактивов: хлористоводородной или серной кислоты, янтарной кислоты (СО2Н(СН2)2СО2Н).
Согласно ДСТУ 7258:2012 используют в качестве установочного вещества только калий гидрофталат C8H6O4K. - Методики определения молярной концентрации титрованных растворов в указанных нормативных документах отличаются.
- Согласно ДСТУ 7258:2012; ДСТУ 7259:2012 и ДСТУ 7260:2012, общей формулы для определения молярной концентрации раствора не указывается, а предоставлены расчетные формулы для определенного титрованного раствора. Коэффициент поправки не определяют. Например:
― молярную концентрацию раствора гидроокиси натрия СNaOH в молях на кубический дециметр вычисляют по формуле: , (13)
, (13)где,
mKHP ― масса калия гидрофталата, израсходованного во время испытания, г;
VNaOH ― объем раствора гидроокиси натрия, использованного во время испытания, см3;
4,89644 ― величина соотношения между количеством кубических сантиметров в 1 дм3 и количеством граммов, которые отвечают 1 молю калия гидрофталата, см3•моль/(дм3•г)
― молярную концентрацию раствора натрия тиосульфата СNaТіо в молях на кубический дециметр вычисляют по формуле: , (14)
, (14)
где,
mк2Cr2O7 ― масса калия двухромовокислого, использованного во время испытания, г;
VNa2Тіо ― объем раствора натрия тиосульфата, израсходованного во время испытания, см3;
20,396 ― величина соотношения между количеством кубических сантиметров в 6 дм3 и количеством граммов, которые отвечают 1 молю калия двухромовокислого, см3•моль/(дм3•г). - Необходимо отметить, что в новых стандартах на титрованные растворы все вычисления производятся с учетом действительных молярных концентраций вещества в растворе, а не молярных концентраций эквивалента в растворе.
- Приведение объемов титрованных растворов при данной температуре к объемам при 20oC не производится. Согласно ДСТУ, учитывают температуры, когда готовили титрованный раствор и выполняли испытание и, согласно «Приложению А», определяют значение поправочного коэффициента F, который учитывает термическое расширение конкретного раствора. Исправленные молярные концентрации компонентов титрованных растворов вычисляют по формуле 1.
Главное преимущество титриметрического метода заключается в быстроте выполнения определений, но без точного знания концентрации раствора нельзя получить достоверных результатов испытаний.
В лаборатории необходимо осуществлять соответствующий контроль сотрудников, выполняющих испытания, с оценкой качества выдаваемых им результатов. Специалист должен не только механически выполнять испытания, но и понимать и анализировать все процессы, происходящие при выполнении измерений, располагать сведениями о возможных ошибках при выполнении конкретного испытания. Это может быть несоответствие качества реактива, расхождение между параллельными определениями и т.д.
На практических занятиях большое внимание уделялось подсчету полученных данных после выполнения измерений. Проводили анализ допустимых расхождений между двумя параллельными определениями конкретного метода, и проводился анализ полученных значений несколькими сотрудниками заводских лабораторий. Наблюдалось, что не все специалисты заводских лабораторий владеют метрологическими терминами и их определениями (например, абсолютная погрешность, относительная погрешность, доверительный интервал и т.д.).
Таким образом, для повышения конкурентоспособности продукции предприятий масложировой отрасли и гарантии достоверности результатов исследований представляется очевидной актуальность компетентности персонала производственных лабораторий в следующих направлениях:
- обеспечить сотрудников лабораторий необходимым уровнем знаний в области аналитической химии, методологии химического анализа, понимая смысла проводимых исследований и тех теоретических предпосылок, которые лежат в основе проведения испытания;
- сотрудник лаборатории должен уметь дать оценку правильности проведенных испытаний и сравнить результат с действующими нормативными документами;
- сотрудник лаборатории обязан быстро ориентироваться в конкретной производственной ситуации, на высоком профессиональном уровне решать различные производственные задачи.
Література:
1. ISO/IЕС 17025:2006 Загальні вимоги до компетентності випробувальних та калібрувальних лабораторій.
2. ДСТУ 7258:2012 Методи готування розчинів для кислотно-лужного титрування та визначення їхньої молярної концентрації.
3. ДСТУ 7259:2012 Методи готування розчинів для окислювально-відновного титрування та визначення їхньої молярної концентрації.
4. ГОСТ 25794.1-83 − ГОСТ 25794.3-83 Методы приготовления титрованных растворов.
5. Белоноко М.В. Персонал // Производственная лаборатория. – 2008 г., № 3 (18), с.11-12.
6. Рамазанова-Степкина Е. А. // Олійно-жировий комплекс. - 2006 р., № 2(13), с 48-49.
7. Павленко В.И. Валидация Методик. Проблемы и решения. Использование програмного обеспечения для автоматизации основных расчетов метрологических характеристик методик при проведении процедуры их валидации // Производственная лаборатория. – 2008 г., № 2 (17), с.18-19.